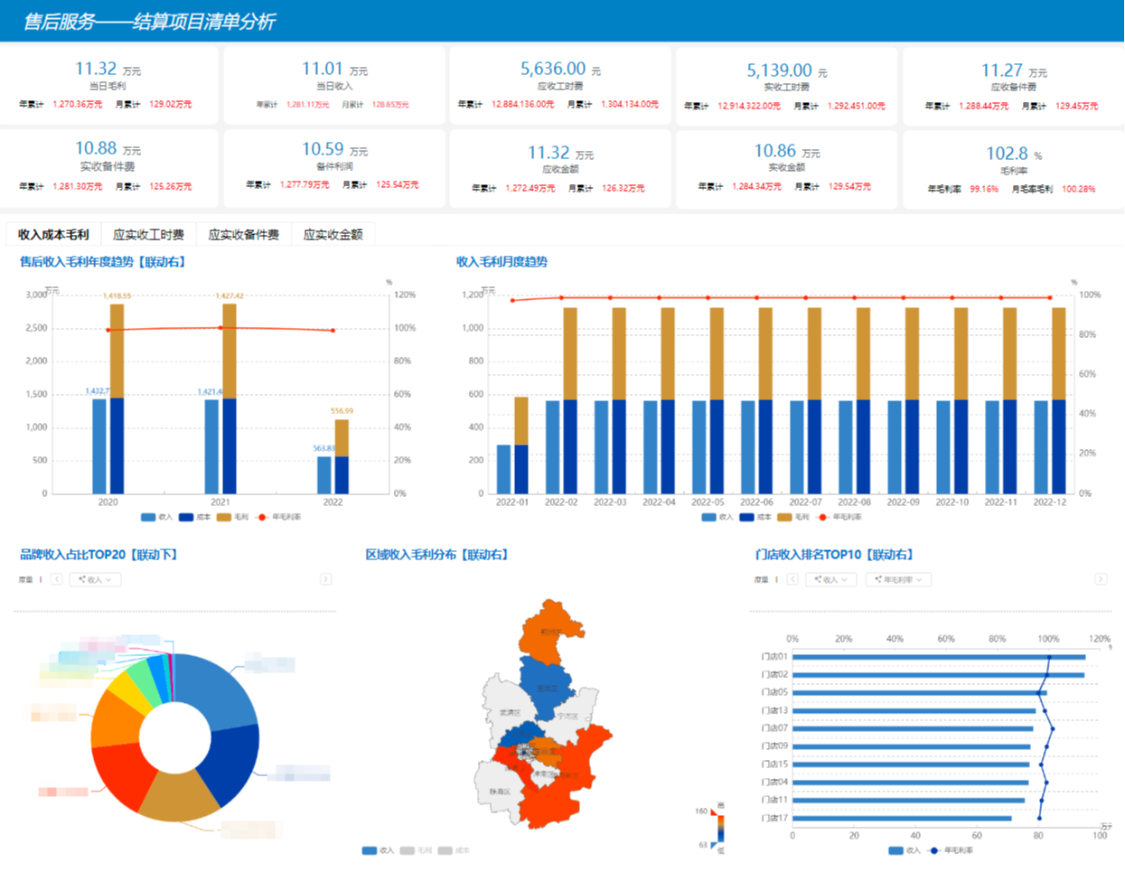
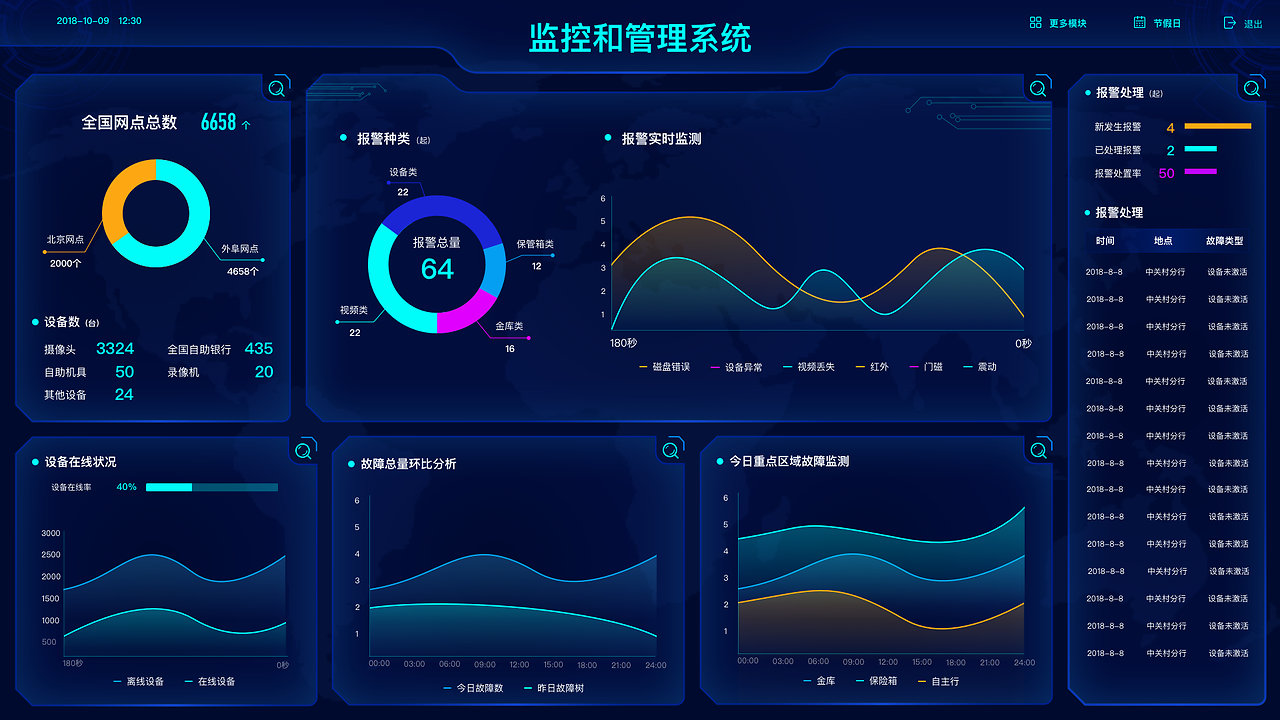
數(shù)據(jù)分析等距集 從基礎(chǔ)概念到實(shí)際應(yīng)用

在數(shù)據(jù)分析與處理領(lǐng)域,等距集是一個(gè)重要的數(shù)學(xué)概念,尤其在數(shù)據(jù)離散化、標(biāo)準(zhǔn)化及可視化過(guò)程中具有廣泛應(yīng)用。本文將深入探討等距集的定義、特性及其在數(shù)據(jù)分析中的實(shí)際價(jià)值。
一、等距集的基本概念
等距集是指在數(shù)值范圍內(nèi)按照固定間隔劃分的數(shù)據(jù)點(diǎn)集合。例如,在區(qū)間[0, 10]內(nèi)以步長(zhǎng)2劃分,可得等距集{0, 2, 4, 6, 8, 10}。這種均勻分布的特性使等距集成為數(shù)據(jù)分箱、直方圖繪制和數(shù)值標(biāo)準(zhǔn)化的理想工具。
二、等距集在數(shù)據(jù)處理中的角色
- 數(shù)據(jù)離散化:連續(xù)型數(shù)據(jù)常需轉(zhuǎn)換為離散類別,等距分箱法通過(guò)設(shè)定固定間隔將數(shù)據(jù)歸入不同區(qū)間,便于后續(xù)分類分析。
- 可視化支持:在繪制直方圖時(shí),等距區(qū)間能清晰展示數(shù)據(jù)分布形態(tài),避免因區(qū)間寬度不一導(dǎo)致的解讀偏差。
- 特征工程:機(jī)器學(xué)習(xí)中,等距離散化可減少連續(xù)特征的噪聲影響,提升模型穩(wěn)定性。
三、實(shí)際應(yīng)用案例分析
以電商用戶年齡分析為例:若將18-60歲用戶按5歲等距劃分,可得到{18-23, 23-28, ..., 58-63}等多個(gè)區(qū)間。通過(guò)統(tǒng)計(jì)各區(qū)間消費(fèi)金額,企業(yè)可精準(zhǔn)識(shí)別核心客群,優(yōu)化營(yíng)銷策略。
四、注意事項(xiàng)與最佳實(shí)踐
使用等距集時(shí)需注意:
- 區(qū)間寬度需兼顧數(shù)據(jù)特性與業(yè)務(wù)需求,過(guò)寬會(huì)損失細(xì)節(jié),過(guò)窄則易受異常值干擾
- 對(duì)于偏態(tài)分布數(shù)據(jù),可結(jié)合分位數(shù)劃分進(jìn)行補(bǔ)充
- 在Python中可通過(guò)numpy.arange()或pandas.cut()快速實(shí)現(xiàn)等距分箱
五、未來(lái)發(fā)展趨勢(shì)
隨著邊緣計(jì)算和實(shí)時(shí)分析需求增長(zhǎng),等距集算法正與流式計(jì)算框架結(jié)合,實(shí)現(xiàn)動(dòng)態(tài)數(shù)據(jù)范圍的自適應(yīng)等距劃分,為物聯(lián)網(wǎng)、金融風(fēng)控等領(lǐng)域提供更高效的數(shù)據(jù)處理方案。
作為數(shù)據(jù)分析的基礎(chǔ)工具,等距集以其簡(jiǎn)潔性和可解釋性,在數(shù)據(jù)預(yù)處理階段持續(xù)發(fā)揮關(guān)鍵作用。掌握其原理并靈活運(yùn)用,將顯著提升數(shù)據(jù)分析的效率與準(zhǔn)確性。
如若轉(zhuǎn)載,請(qǐng)注明出處:http://www.unicycling.cn/product/21.html
更新時(shí)間:2026-03-09 18:15:56